|
|
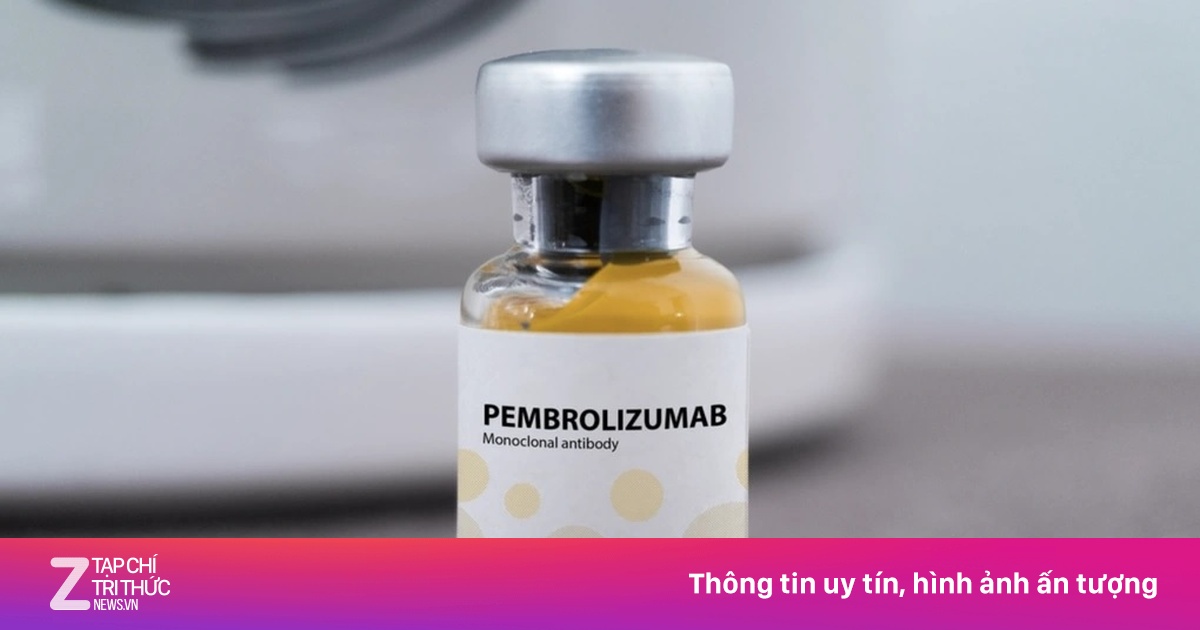
Thuốc Pembroria có hoạt chất chính là Pembrolizumab. Ảnh: Incentra. |
Cục Quản lý Dược, Bộ Y tế, cho biết đơn vị đã ban hành Quyết định số 628/QĐ-QLD ngày 31/10 về 14 vaccine, sinh phẩm được cấp giấy đăng ký lưu hành tại Việt Nam.
Trong đó, có thuốc Pembroria (hoạt chất chính là Pembrolizumab, hàm lượng 100mg/4ml) do Công ty Limited Liability "PK-137" (Nga) sản xuất, được một cơ sở ở Các Tiểu Vương quốc Ả Rập Thống nhất đăng ký.
Thuốc Pembroria được bào chế dưới dạng dung dịch đậm đặc pha dung dịch tiêm truyền, có hạn sử dụng 24 tháng kể từ ngày sản xuất.
Pembrolizumab hiện có hơn 14 chỉ định cho các loại ung thư khác nhau (như ung thư biểu mô phổi, u hắc tố, ung thư đại trực tràng, ung thư cổ tử cung, ung thư biểu mô tế bào thận, ung thư vú...).
Theo Cục Quản lý Dược, sau khi được cấp giấy đăng ký lưu hành, công ty phải định kỳ 3 tháng một lần kể từ ngày cấp giấy đăng ký lưu hành thực hiện cập nhật tiến độ triển khai nghiên cứu lâm sàng theo dõi tính sinh miễn dịch pha III. Nộp hồ sơ thay đổi, bổ sung cập nhật dữ liệu theo dõi tính sinh miễn dịch pha III khi thời gian nghiên cứu kết thúc.
Ngoài Pembroria, các loại vaccine, sinh phẩm được cấp giấy đăng ký lưu hành bao gồm:
Cục Quản lý Dược yêu cầu các đơn vị phải có trách nhiệm tất cả thuốc sản xuất và cung cấp vào Việt Nam phải tuân thủ hồ sơ, tài liệu đã đăng ký với Bộ Y tế. Mỗi sản phẩm đều phải in hoặc dán số đăng ký do Bộ Y tế cấp lên nhãn thuốc để đảm bảo minh bạch và truy xuất nguồn gốc.
Các cơ sở này phải chấp hành đầy đủ pháp luật Việt Nam và các quy định của Bộ Y tế về sản xuất, nhập khẩu và lưu hành thuốc. Nếu có bất kỳ thay đổi nào liên quan đến thuốc trong quá trình lưu hành ở nước sở tại hoặc tại Việt Nam, cơ sở phải báo cáo ngay cho Cục Quản lý Dược, Bộ Y tế.
Đối với cơ sở đăng ký thuốc, việc duy trì thực hành tốt sản xuất (GMP) của cơ sở sản xuất thuốc và nguyên liệu là bắt buộc. Trong trường hợp cơ sở sản xuất bị thu hồi giấy phép hoặc không còn đáp ứng tiêu chuẩn GMP tại nước sở tại, cơ sở đăng ký thuốc phải báo cáo cho Bộ Y tế trong vòng 15 ngày kể từ ngày nhận thông báo chính thức, theo quy định tại Điều 98 Nghị định 163/2025/NĐ-CP.
Bên cạnh đó, các cơ sở sản xuất và đăng ký thuốc cần phối hợp với cơ sở điều trị và cơ sở y tế dự phòng để thực hiện đầy đủ các quy định về thuốc kê đơn, theo dõi an toàn, hiệu quả, tác dụng không mong muốn trên người Việt Nam.
Trong cuốn sách Sống khỏe mạnh không phụ thuộc vào thuốc, giáo sư Ryoko Chiba cho rằng nguyên tắc cơ bản khi sử dụng thuốc trong cuộc sống thường ngày chính là “ngắn và cụ thể”. Khi nào bị bệnh thì uống thuốc. Hết bệnh thì nhanh chóng ngừng thuốc. Tuy nhiên, nếu chỉ thay đổi mỗi cách sử dụng thuốc thì chúng ta không thể khỏe mạnh lên. Để thật sự khỏe mạnh, mỗi chúng ta cũng cần thay đổi cả thói quen sống và cách suy nghĩ của mình.